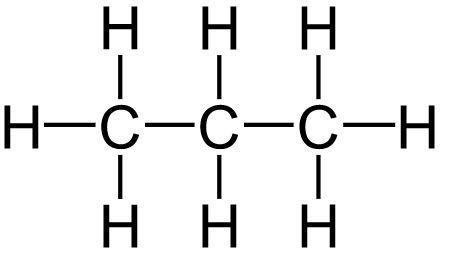
Dalam kimia, rumus molekul menjadi cara untuk menggambarkan komposisi kimia dari suatu senyawa. Hidrokarbon adalah senyawa kimia yang terdiri dari karbon dan hidrogen saja. Ada tiga jenis utama hidrokarbon alami, yakni hidrokarbon jenuh, tak jenuh, dan aromatik.
Contoh rumus molekul yang menyatakan hidrokarbon jenuh adalah CnH2n+2, di mana “n” mewakili jumlah atom karbon dalam molekul tersebut.
Rumus ini menggambarkan bahwa setiap atom karbon dalam senyawa ini berikatan dengan empat atom hidrogen, sehingga karbon dianggap “jenuh” dengan hidrogen.
Rumus molekul ini memegang peranan penting dalam memahami sifat dan karakteristik dari hidrokarbon jenuh. Dengan mengetahui rumus molekulnya, kita dapat memprediksi berbagai sifat fisik dan kimia dari senyawa tersebut, seperti titik didih, titik leleh, dan reaktivitas kimianya.
Penerapan praktis dari pemahaman rumus molekul hidrokarbon jenuh sangat luas, terutama dalam industri minyak dan gas. Dengan demikian, pemahaman akan rumus molekul yang menyatakan hidrokarbon jenuh ini menjadi kunci utama dalam menjelajahi potensi dan aplikasi dari senyawa ini dalam berbagai industri.
Table of Contents
Apa itu Hidrokabon Jenuh?
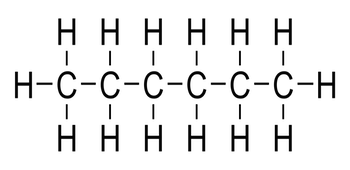
Hidrokarbon jenuh adalah jenis senyawa kimia yang memiliki ikatan tunggal di antara atom karbonnya. Mereka disebut “jenuh” karena setiap atom karbon di dalam molekul tersebut terikat dengan atom hidrogen sebanyak mungkin.
Ini berarti terdapat lebih banyak atom hidrogen yang terikat pada atom karbon. Secara sederhana, hidrokarbon jenuh menjadi senyawa di mana setiap atom karbon terikat pada empat atom lainnya, serta tidak terdapat ikatan ganda antara atom karbon dalam molekulnya.
Contoh yang mudah dipahami dari hidrokarbon jenuh adalah etana yang merupakan senyawa sederhana dengan dua atom karbon dalam molekulnya.
Dalam etana, setiap atom karbon terikat pada tiga atom hidrogen. Ini dapat dijelaskan dengan rumus struktur, di mana setiap tanda hubung (-) antara atom karbon dan hidrogen melambangkan ikatan tunggal, di mana dua atom berbagi satu pasang elektron valensi.
Baca juga: 6 Hal tentang Rumus Tangga Nada Mayor yang Benar
Secara umum, semua hidrokarbon jenuh disebut alkana. Mereka merupakan kelas hidrokarbon yang paling sederhana dengan struktur yang mudah dipahami.
Hidrokarbon jenuh memiliki banyak aplikasi dalam industri dan kehidupan sehari-hari dan pemahaman tentang sifat-sifat kimianya penting untuk berbagai keperluan ilmiah dan teknis.
Jenis-jenis Hidrokarbon Jenuh
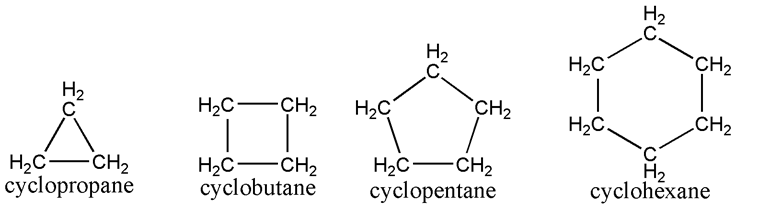
Hidrokarbon jenuh dapat memiliki struktur yang bervariasi, seperti linier, bercabang, atau berbentuk cincin. Ini menghasilkan tiga jenis utama hidrokarbon jenuh, yakni alkana dan sikloalkana.
Kedua jenis hidrokarbon jenuh ini dapat menunjukkan isomerisme rantai, di mana molekul yang sama dapat memiliki struktur rantai yang berbeda.
Alkana
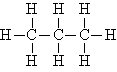
Alkana adalah senyawa organik yang terdiri dari atom karbon dan hidrogen yang dihubungkan oleh ikatan tunggal dan tidak memiliki gugus fungsi lain.
Molekul alkana hampir seluruhnya terdiri dari hibridisasi sp³, di mana semua atom karbon membentuk empat ikatan tunggal dengan atom hidrogen atau atom karbon lainnya.
Titik leleh dan titik didih alkana biasanya meningkat seiring dengan bertambahnya panjang rantai karbon dalam molekulnya. Ini disebabkan oleh peningkatan berat molekul, karena molekul dengan rantai karbon yang lebih panjang memiliki berat molekul yang lebih tinggi.
Alkana menjadi jenis hidrokarbon yang paling sederhana dan paling tidak reaktif. Ini karena mereka hanya terdiri dari karbon dan hidrogen, sehingga tidak memiliki gugus fungsi yang dapat bereaksi dengan senyawa lain.
Sebagian besar alkana dengan lebih dari 18 atom karbon berbentuk padat pada suhu kamar. Alkana dapat menunjukkan isomerisme rantai, di mana molekul yang sama dapat memiliki struktur rantai yang berbeda. Jumlah total atom karbon dalam suatu alkana menentukan jumlah kemungkinan isomer rantai yang mungkin ada.
Sebagai contoh, butana C4H10 memiliki dua isomer rantai, yaitu n-butana dan isobutana. Untuk butana, dua isomer ini terbentuk karena atom karbon keempat dapat terikat ke rantai utama n-butana atau menjadi bagian dari rantai samping isobutana.
Baca juga: 11 Penulisan Rumus Excel yang Benar dan Paling Sering Dipakai
Namun, pada oktan C8H18, jumlah kemungkinan isomer rantai meningkat secara signifikan karena ada lebih banyak atom karbon yang dapat berpartisipasi dalam berbagai struktur rantai.
Sikloalkana
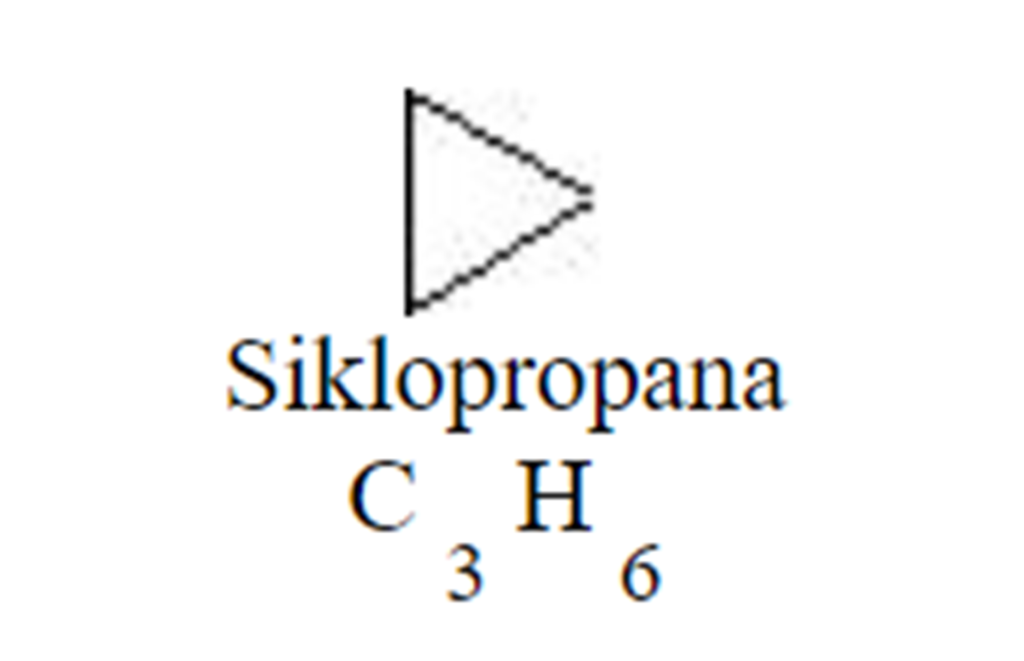
Sikloalkana adalah jenis alkana yang memiliki struktur cincin karbon. Meskipun memiliki sifat fisik yang mirip dengan alkana, seperti titik didih dan titik leleh, sikloalkana memiliki titik didih, titik leleh, dan massa jenis yang lebih tinggi.
Hal ini disebabkan oleh Gaya London yang lebih besar pada molekul-molekul sikloalkana. Cincin karbon dalam sikloalkana telah mengalami hibridisasi sp³ yang membuatnya memiliki struktur tiga dimensi yang berbeda dengan alkana.
Meskipun memiliki sifat fisik yang mirip dengan alkana, sikloalkana memiliki beberapa perbedaan. Titik leleh dan titik didih sikloalkana cenderung lebih tinggi daripada alkana dengan jumlah atom karbon yang sama.
Hal ini disebabkan oleh struktur cincin yang lebih padat dan tertutup pada sikloalkana. Namun, sikloalkana juga rentan terhadap regangan cincin karena struktur cincinnya yang kaku.
Sebagai contoh, siklopropana memiliki sudut ikatan karbon-karbon sebesar 60 derajat, yang membuatnya memiliki regangan cincin tertinggi di antara sikloalkana lainnya.
Perbedaan Hidrokarbon Jenuh dan Hidrokarbon Tak Jenuh
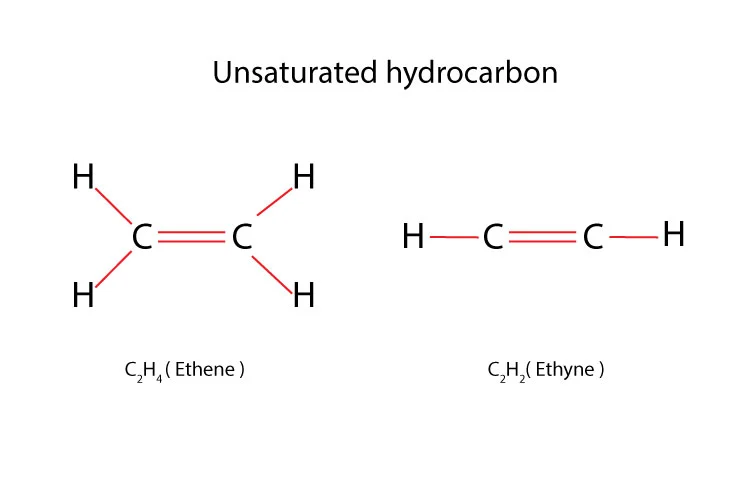
Perbedaan utama antara hidrokarbon jenuh dan tak jenuh terletak pada ikatan antar atom karbon dalam molekul. Hidrokarbon jenuh hanya memiliki ikatan kovalen tunggal antar atom karbon, sementara hidrokarbon tak jenuh memiliki setidaknya satu ikatan kovalen ganda atau rangkap tiga dalam rantai utamanya.
Karena struktur molekul yang berbeda, kedua jenis hidrokarbon ini memiliki sifat yang berbeda pula. Hidrokarbon tak jenuh dapat dibedakan dengan adanya cincin benzena atau perilaku kimia yang mirip dengan benzena. Mereka memiliki tiga ikatan rangkap yang bergantian dengan ikatan tunggal antar atom karbon dalam struktur cincin.
Senyawa aromatik, yang termasuk dalam hidrokarbon tak jenuh, cenderung lebih reaktif dan memiliki solvabilitas yang lebih tinggi daripada parafin dan naftenat karena memiliki banyak senyawa yang dapat bereaksi dengan ikatan lain.
Senyawa aromatik juga mudah mengalami substitusi elektrofilik, di mana gugus molekul aktif seperti nitrat, sulfonat, dan halogen dapat membentuk senyawa aromatik baru. Aromatik banyak digunakan dalam industri petrokimia untuk membuat obat-obatan, pewarna, plastik, dan berbagai bahan kimia lainnya.
Dalam klasifikasi hidrokarbon tak jenuh, terdapat alkena dengan satu ikatan rangkap dan alkuna dengan satu ikatan rangkap tiga, keduanya termasuk dalam kategori hidrokarbon tak jenuh.
Kegunaan Hidrokarbon Jenuh
Hidrokarbon jenuh memiliki beragam kegunaan yang penting dalam berbagai industri. Apalagi, ebagian besar bahan bakar yang kita gunakan terbuat dari hidrokarbon jenuh.
Secara sederhana, berikut ini adalah beberapa kegunaan hidrokarbon jenuh:
- Metana digunakan sebagai bahan bakar roket cair dan sebagai gas untuk menggerakkan mobil, pemanas air, dan oven.
- Alkana dan sikloalkana merupakan komponen utama dalam bensin, nafta, bahan bakar jet, dan campuran pelarut khusus yang digunakan dalam industri.
- Etana digunakan sebagai pendingin dalam beberapa sistem pendingin kriogenik, dan dapat juga digunakan untuk membuat gas etilen.
- Propana digunakan sebagai propelan dalam semprotan aerosol, bahan bakar pada balon udara, dan untuk membuat gas propilena.
Hidrokarbon jenuh memiliki peran yang sangat penting dalam industri dan kehidupan sehari-hari karena kegunaannya yang beragam dan sifat yang stabil.
Baca juga: Coba 6 Cara Mudah Setting Proxy Browser Ini Secara Gratis
Rumus-rumus Molekul yang Menyatakan Hidrokarbon Jenuh
Hidrokarbon jenuh yang juga dikenal sebagai alkana, memiliki pola penamaan khusus. Nama alkana selalu diakhiri dengan sufiks “-ane”. Bagian pertama dari nama alkana menunjukkan jumlah atom karbon dalam molekulnya.
Misalnya, metana adalah alkana terkecil dengan satu atom karbon, sementara etana memiliki dua atom karbon. Rumus kimia dan sifat-sifat fisik seperti titik didih dan titik leleh alkana kecil tergantung pada jumlah atom karbon dalam molekulnya.
Rumus kimia dan sifat fisik seperti titik didih dan titik leleh alkana kecil bergantung pada jumlah atom karbon dalam molekulnya. Berikuit ini adalah tabel berisikan rumus-rumus molekul yang menyatakan hidrokarbon jenuh.
| Nama | Rumus Molekul | Rumus Struktur | Gugus Alkil |
| Metana | CH4 | CH4 | Methyl |
| Etana | C2H6 | CH3-CH3 | Ethyl |
| Propana | C3H8 | CH3-CH2-CH3 | Propyl |
| Butana | C4H10 | CH3-CH2-CH2-CH3 | Butyl |
| Pentana | C5H12 | CH3CH2CH2CH2CH3 atau CH3-(CH2)3-CH3 | Pentyl |
| Heksana | C6H14 | CH3-(CH2)4-CH3 | Hexyl |
| Heptan | C7H16 | CH3-(CH2)5-CH3 | Heptyl |
| Oktan | C8H18 | CH3-(CH2)6-CH3 | Octyl |
| Nonana | C9H20 | CH3-(CH2)7-CH3 | Nonyl |
| Dekana | C10H22 | CH3-(CH2)8-CH3 | Decyl |
Rumus molekul yang menyatakan hidrokarbon jenuh atau alkana menghasilkan senyawa yang terdiri dari atom karbon dan hidrogen dengan ikatan tunggal antar atom karbon.
Nama alkana selalu diakhiri dengan sufiks “-ane” dan bagian pertama namanya menunjukkan jumlah atom karbon dalam molekulnya. Sifat fisik seperti titik didih dan titik leleh alkana terutama ditentukan oleh jumlah atom karbon dalam molekulnya.
hidrokarbon jenuh atau alkana merupakan bagian penting dari industri dan kehidupan sehari-hari, digunakan sebagai bahan bakar, bahan dasar plastik, pelumas, dan berbagai produk kimia lainnya.
Kalau saat ini kamu membutuhkan jasa penulisan artikel, jangan ragu untuk menghubungi Optimaise. Optimaise menawarkan jasa pembuatan artikel yang dapat membantumu menyajikan informasi kompleks dengan cara yang mudah dipahami. Dengan tim penulis yang berpengalaman, Optimaise dapat membantu menghasilkan artikel-artikel informatif dan menarik untuk memenuhi kebutuhanmu.